关于拟采购临床试验全过程信息管理系统项目信息发布
关于拟采购临床试验全过程信息管理系统项目信息发布
一、建设背景
根据《药物临床试验质量管理规范》和《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》的要求,医疗机构开展临床试验、临床研究必须保证过程规范,数据和结果的科学、真实、可靠,保护受试者的权益和安全。
目前我院目前在研的临床试验约25项、IIT项目约50项,近两年项目量翻倍增长中。目前我院对项目的立项审查、伦理审查、过程管理、质控等相关工作皆以人工方式完成,重复性工序多,全过程管理流程涉及多部门,容易出现人为差错,影响工作效率,不能有效保证临床试验质量。为提升工作效率,减少管理过程中的人为差错,实现信息闭环管理,保证临床试验质量。
二、项目建设内容如下:
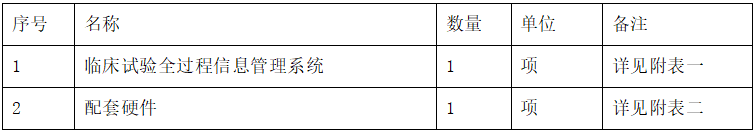
附表一:功能模块
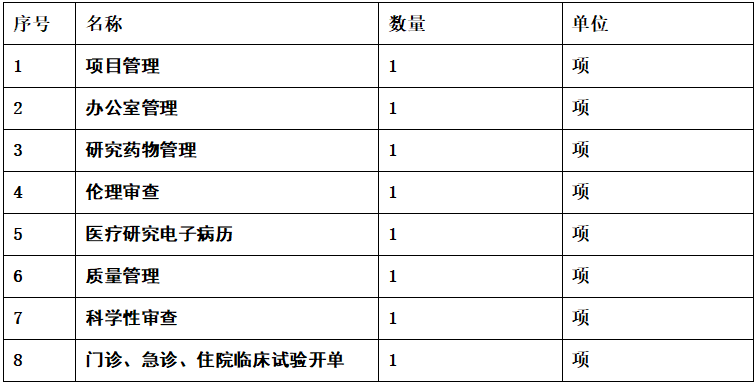
2、功能模块技术要求:
(一)、项目管理
说明(Commentary):
1. 项目信息
药物临床试验机构办公室办公室
科研管理科:
CRA/CRC
研究者
系统控制:项目信息中填写的主要研究者,即被授权可以进行该项目的管理,如授权项目的研究人员,电子病历的研究设计。
2. 立项管理(仅用于药物临床试验机构办公室所管辖范围内的所有项目)
3. 伦理审查信息
4. 合同管理
5. 经费预算与审核
6. 人遗资料
7. 项目培训(研究开始前培训)
8. 档案管理
9. 研究状态
10.统计报表
(二)、办公室管理
说明(Commentary):
1. 合同审计:仅限药物临床试验机构办公室的合同
2. 人员管理
3. 培训管理(药物临床试验机构办公室、科研管理科、教学培训科等所有可能报销国内外培训费用的部门)
4. 字典(下拉菜单的字段)
5. 模板
6. 用户权限
(三)、研究药物管理(免费的药品、试验药物,独立于现有的药物管理系统)
说明(Commentary):
1. 信息设定
2. 药库
系统的记录表单均可下载打印
2.1 验收入库
2.2 领药出库
2.3 发药与回收记录
2.3.1 发药
2.3.2 查询
2.4 返还记录
(四)、伦理审查
说明(Commentary):
1. 审查流程
1.1 项目信息
1.2 送审:研究人员
1.3 受理
1.4 处理
1.5 审查
1.6 传达决定
1.7 文件存档
2. 审查会议
2.1 会议准备
2.2 会议审查
3. 办公室管理
3.1 委员管理
3.2 费用管理
3.3 培训管理
3.4 受试者抱怨
3.5 实地访查
3.6 提醒
3.7 统计报表
3.8 查询
3.8.1 查询项目
3.8.2 查询会议
3.9 字典(下拉菜单的字段)
3.10 模板
3.11 用户权限
(五)、医疗研究电子病历:药物临床试验机构办公室
说明(Commentary):
适用Ⅰ期临床试验和生物等效性临床试验。
涉及临床药学室门诊和Ⅰ期病房。
所有临床药学室门诊和Ⅰ期病房的挂号,理化检查的费用均内部转账模式。
临床药理科研究者(医生)负责其所承担的研究项目管理与电子病历的记录。
医院研究管理部门有权查阅其管理的所有研究项目(区分科研管理科和药物临床试验机构办公室)。
关联《研究管理》字段:项目名称,承担科室,(申办者,期类别),主要研究者,研究人员。
1. 临床药学室门诊
1.1(健康志愿者)招募筛选
出院受试者的随访观察
2. Ⅰ期病房
2.1 研究项目设计
2.2 电子病历记录
2.3 病例报告表
2.4 数据库(统计报表)
系统根据病历记录,自动生成研究项目的数据库(统计报表)
(六)、质量管理
说明(Commentary):
适用所有临床研究课题,药物Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期临床试验和生物等效性临床试验。
涉及所有医疗病区,门诊,急诊,以及临床药理科门诊和Ⅰ期病房。
质量管理部门有权对其管理的所有研究项目进行质量检查和记录(区分科研管理科/课题负责人和药物临床试验机构办公室)。
监查员、稽查员有权对被授权的研究项目进行质量检查。
关联《研究管理》的项目信息有关字段,以及研究管理部门。
1. 质量检查记录(区分科研管理科/课题负责人和药物临床试验机构办公室)
2. 监查、稽查记录(仅限药物临床试验机构办公室)
(七)、科学性审查
说明(Commentary):
适用所有临床研究课题,药物Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期临床试验和生物等效性临床试验。
涉及所有医疗病区,药物临床试验机构办公室、学术委员会、科研管理科、研究者。
1. 审查流程
1.1 项目信息
1.2 送审:研究人员
1.3 受理
1.4 处理
1.5 审查
1.6 传达决定
1.7 文件存档
2. 审查会议
2.1 会议准备
2.2 会议审查
(八)、门诊、急诊、住院临床试验开单
说明(Commentary):
适用IIT、Ⅱ期、Ⅲ期、Ⅳ期临床试验和生物等效性临床试验。
涉及所有医疗病区,门诊,急诊,以及临床药理科门诊和Ⅰ期病房。
1. 内嵌页面
2. 权限
3. 加入临床试验
4. 禁用药提醒
5. 统计查询
附表二:硬件配置
附表一:
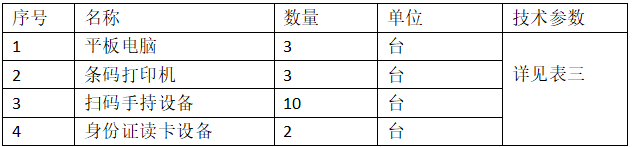
表三:硬件技术参数

三、项目建设要求
(1) 本次建设项目需要与医院现有的需与医院各大系统对接,如HIS、LIS、PACS、EMR、HRP、科研大数据平台、信息集成平台、我院微信公众号等相关系统进行对接工作 ,相关接口费由中标厂商承担。
(2)本次建设项目需要符合《网络安全法》、《数据安全法》、《个人信息保护法》等法律要求,符合电子病历系统应用水平5级及以上,医院信息互联互通标准化成熟度四级甲等及以上的相关要求,符合网络安全等级保护2级以上的要求,维保期内无条件配合完成医院上级管理部门交予的各项指令性任务及整改要求,满足高水平医院信息化管理各项要求。
(3)本项目为系统集成项目,投标人应对本系统整体负责。投标人应按照系统要求同时提供所需硬件配置明细表、系统软件及应用软件明细表等。对于投标文件中未列出但系统正常运行又必需的各类部件以及软件等,投标人必须补齐并将有关价格含入投标价格中,否则将视为免费提供。
(4)投标人所交付的硬件产品,其所有部件必须都是原厂原装部件,而且产品应是交付前最新生产且未被使用过的全新产品,同时必须具有在中国境内的合法使用权。
(5)本用户需求书中列出了采购人可以接受的最小的技术指标。投标人推荐的每一项的硬件及软件必须在速度、容量、性能等方面不低于表中所列的各项指标。
(6)投标人所提供的软件应符合下列工作环境准则且能够在相应条件下稳定运行:
环境温度:+10℃ - +35℃
操作时:20% -80%
非操作时:20% -80%
电源:220V单相,或380V三相;50/60Hz
(7)投标人必须承诺对所有产品提供原厂商不少于一年的免费保修服务。
(8)负责招标文件中列出的所有软件进行安装、调优。投标人负责提供原厂软件平台的技术支持服务和软件升级服务。
四、报名材料
1、产品(服务)内容;
2、产品(服务)报价清单(报价需注明是否含税)以及所投厂商出具的项目授权函及售后服务承诺函原件;
3、企业营业执照、税务登记证、组织机构代码证(以上资料复印件加盖公章)(若报价人已办理三证合一,则只需提供营业执照);
4、公司业绩及案例客户清单等;
5、联系人的姓名、职务、电话。
五、有关事项
(一)本信息自发布之日起5个自然日止,挂网期止后我院将根据情况通知报名单位前来推介洽谈;
(二)从信息发布之日起至挂网期止,有资质的企业均可报名。报名资料可上门递交或速递至“湛江中心人民医院信息科”。地址:广东省湛江市赤坎区源珠路236号。邮编:******。电话:(工作日)0759—*******、*******(上午8:00-12:00,下午14:30-17:30) 联系人:欧工:138*****864。
(三)本次推介会要求以PPT形式进行介绍演示,内容包括:单位简况、产品(服务)方案、主要业绩、项目报价(含税等)、同类项目介绍、售后服务(注明维保年限)等;
(四)本次推介会并非正式采购行为,各公司所提供的相关信息仅有助于采购单位对该项目的认知。正式采购程序将依照《中华人民共和国政府采购法》以及广东省人民政府、湛江市人民政府及本单位的相关规定办理;
(五)报名单位须对其所提供的资料的真实性负责,如有作假,一经发现,立即取消资格,在二年内禁止参与我单位的所有项目邀请。
湛江中心人民医院
信息科
2022年11月24日
|
招标
|
- 关注我们可获得更多采购需求 |
关注 |
最近搜索
无
热门搜索
无
